反应 N2O5 (g) = N2O4(g) + ½ O2(g) 的△rHmө=41.84 kJ·mol-1,为了提高N2O4 的产率,可以采
反应 N2O5 (g) = N2O4(g) + ½ O2(g) 的△rHmө=41.84 kJ·mol-1,为了提高N2O4 的产率,可以采取的措施是()
A降低温度、提高压力
B降低压力、提高温度
C降低温度、降低压力
D提高温度、提高压力
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
反应 N2O5 (g) = N2O4(g) + ½ O2(g) 的△rHmө=41.84 kJ·mol-1,为了提高N2O4 的产率,可以采取的措施是()
A降低温度、提高压力
B降低压力、提高温度
C降低温度、降低压力
D提高温度、提高压力
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“反应 N2O5 (g) = N2O4(g) + ½ O2(g…”相关的问题
更多“反应 N2O5 (g) = N2O4(g) + ½ O2(g…”相关的问题
第1题
65℃时进行反应N2O5(g)=N2O4(g)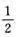 +O2(g),测得N2O5的分解速率常数为0.292min-1,反应的活化能为103kJ·mol-1,计算15℃时此反应的k及t1/2.
+O2(g),测得N2O5的分解速率常数为0.292min-1,反应的活化能为103kJ·mol-1,计算15℃时此反应的k及t1/2.
第2题
298K时,N2O5(g)====N2O4(g)+
(1) 该反应的速率常数;
(2) N2O5(g)转化掉90%所需的时间。
第3题
 为41.84kJ·mol-1,△Cp,m=0。要增加N2O4的产率可以:( )。
为41.84kJ·mol-1,△Cp,m=0。要增加N2O4的产率可以:( )。A.降低温度
B.提高温度
C.提高压力
D.等温等容加入惰性气体
第4题
A.提高温度
B.降低温度
C.降低压力
D.等温等压加入惰性气体
第5题
A.提高温度
B.降低温度
C.降低压力
D.等温等压加入惰性气体
第6题
A.向生成NO2(g)的反向进行
B.正好达到平衡
C.难以判断其进行方向
D.向生成N2O5(g) 的方向进行
第7题
A.向生成NO2(g)的反向进行
B.正好达到平衡
C.难以判断其进行方向
D.向生成N2O5(g) 的方向进行
第8题
A.向生成NO2(g)的反向进行
B.正好达到平衡
C.难以判断其进行方向
D.向生成N2O5(g) 的方向进行
第9题
问题1、1840年Devil用干燥的氧气通过干燥的硝酸银,得到N2O5,该反应的氧化产物是一种参与大气循环的气体,写出该反应的化学方程式()。
问题2、F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应
2N205(g)→4NO2(g)+O2(g)+Q1(Q1<0),2NO2(g) N204(g)+Q2(Q2>0)
N204(g)+Q2(Q2>0)
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强P随时间t的变化如下表所示(t=00时,N2O5(g)完全分解);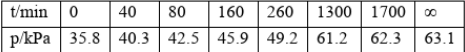
①究表明,N2O5(g)分解的速率v=2x10-3Xpn2o5(kPa'min)。t=62min时,测得体系Po2=2.9kPa,则此时PN2O5:=()kPa,v=()(kPa/min)。
②若提高反应温度至35℃,则N2O5(g)完全分解后体系压强P00(35℃)()63.1kPa(填“大于”、“等于”或“小于”),试从勒夏特列原理的角度加以解释()。
③写岀N2O4(g) 2NO2(g)反应的平衡常数表达式()。
2NO2(g)反应的平衡常数表达式()。
问题3、对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步:N2O5 NO2+NO3快速平衡
NO2+NO3快速平衡
第二步NO2+NO3→NO+NO2+O2慢反应
第三步NO+NO3→2NO2快反应
其中可近似认为第二步反应不影响第一步的平渐。下列表述错误的是()(填编号),
A.v(第一步反应的逆反应)>v(第二步反应)B.反应的中间产物只有NO3
C、该反应的速率主要由第二步决定D.N2O5的分解率主要由第一步决定
第10题
N2O5的分解反应
2N2O5(g)→4NO2(g)+O2(g)
由实验测得在340K时N2O5的浓度随时间的变化如下:

t/min | 0 | 1 | 2 | 3 | 4 | 5 |
[N2O5]/(mol·dom-3) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |


为了保护您的账号安全,请在“赏学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 赏学吧
赏学吧



 微信搜一搜
微信搜一搜
 赏学吧
赏学吧