题目内容
(请给出正确答案)
[判断题]
温度升高,反应速率加快,所以可逆反应的标准平衡常数增大。()
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“温度升高,反应速率加快,所以可逆反应的标准平衡常数增大。()”相关的问题
更多“温度升高,反应速率加快,所以可逆反应的标准平衡常数增大。()”相关的问题
第1题
A.升高温度,可以加快反应速率,缩短可逆反应达到平衡的时间
B.化学反应达到最大限度时,正逆反应速率也达到最大且相等
C.增加固体反应物的量可以加快反应速率
D.用铁片和稀硫酸反应制H2比用的浓硫酸产生H2的速率慢
第2题
A.增大压力
B.增大D的浓度
C.使用催化剂
D.升高温度
第4题
升高温度,使吸热反应的反应速率加快,放热反应的反应速率减慢,所以升高温度使平衡向吸热反应方向移动。( )
第8题
A.达到平衡时,反应物的浓度和生成物的浓度相等
B.达到平衡时,反应物和生成物的浓度不随时间的变化而变化
C.由于反应前后分子数相等,所以增加压力对平衡没有影响
D.升高温度使正反应速率增大,逆反应速率减小,结果平衡向右移
第9题
对于可逆反应:
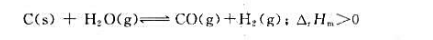
下列说法是否正确?为什么?
(1)达到化学平衡时各反应物和生成物的分压一定相等;
(2)改变生成物的分压,使
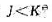 ,化学平衡向右移动;
,化学平衡向右移动;
(3)升高温度使正反应速率增大,逆反应速率减小,故化学平衡向右移动;
(4)由于反应前后分子数相等,所以增大压力对化学平衡没有影响;
(5)加入催化剂使正反应速率增大,化学平衡向右移动。
第10题
A.吸热有利不利减慢
B.吸热有利不利加快
C.放热不利有利加快
D.放热不利不利减慢


为了保护您的账号安全,请在“赏学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 赏学吧
赏学吧



 微信搜一搜
微信搜一搜
 赏学吧
赏学吧