在:pH=4的乙酸盐缓冲溶液中,用铜电极电解1.000×10-2 mol?L-1ZnSO4溶液,在实验使用的电流密度下,H
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“在:pH=4的乙酸盐缓冲溶液中,用铜电极电解1.000×10…”相关的问题
更多“在:pH=4的乙酸盐缓冲溶液中,用铜电极电解1.000×10…”相关的问题
第1题
电解1 mol·L-1FeSO4和1 mol·L-1ZnSO4的混合溶液,用石墨作电极,在阳极的产物是()。

第3题
在0.50mol·L-1H2SO4溶液中电解1.00×10-3mol·L-1ZnSO4溶液,锌是否可在镀锌的铂电极上析出?如果介质c(H+)=1.00×10-5mol·L-1时,锌是否能析出?已知,在锌电极上η(H2)=-0.70V,(Zn2+/Zn)=-0.763V。
第4题
在pH=2的硫酸溶液中,电解0.1000mol·L-1CuSO4溶液,已知氧在铂电极上析出,且分压为101325Pa,试计算铜开始析出时的分解电压是多大?(已知E (Cu2+/cu)=0.337V,E
(Cu2+/cu)=0.337V,E (O2/H2O)=1.23V)
(O2/H2O)=1.23V)
第5题
在含有1.000 mol?L-1硫酸锌与1.000 mol?L-1硫酸镉的1.0 mol?L-1的硫酸介质中,进行电解实验。
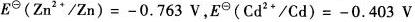 试计算:(1)电解时,锌和镉何者先析出? (2)能否在实验中完全分离锌和镉? (3)在铂和汞电极上,氢的析出是否干扰锌和镉的析出?(已知在铂和汞电极上的ηH2分别为一0.2 V和一1.0 V,ηZn和ηcd均为零)。
试计算:(1)电解时,锌和镉何者先析出? (2)能否在实验中完全分离锌和镉? (3)在铂和汞电极上,氢的析出是否干扰锌和镉的析出?(已知在铂和汞电极上的ηH2分别为一0.2 V和一1.0 V,ηZn和ηcd均为零)。
第6题
在电解中电流密度为0.01 A·cm-2时,氢在电极上的超电位为-0.40 V,若在pH=3的缓冲溶液中,Cu2+能沉积完全吗?
第7题
某试液含有1.000mol·L-1Cu2+和1.000×10-2mol·L-1Ag+,若以铂电极进行电解,在阴极上首先析出的是铜还是银?两种离子是否可以电解分离?(E(Cu2+/Cu)=0.337V,E(Ag+/Ag)=0.799V)


为了保护您的账号安全,请在“赏学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 赏学吧
赏学吧



 微信搜一搜
微信搜一搜
 赏学吧
赏学吧