有一酸催化反应,已知该反应的速率公式为 当[A]0=[B]0=0.01mol·dm-3,在pH=2的条件下,298K时的反应半衰期
有一酸催化反应![有一酸催化反应,已知该反应的速率公式为 当[A]0=[B]0=0.01mol·dm-3,在pH](https://img2.soutiyun.com/ask/6045001-6048000/f1b7b9b44d29f11f9ce6b997ab41bfce.jpg) ,已知该反应的速率公式为
,已知该反应的速率公式为
当[A]0=[B]0=0.01mol·dm-3,在pH=2的条件下,298K时的反应半衰期为1h,若其他条件均不变,在288K时t1/2=2h。试计算在298 K时,
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
有一酸催化反应![有一酸催化反应,已知该反应的速率公式为 当[A]0=[B]0=0.01mol·dm-3,在pH](https://img2.soutiyun.com/ask/6045001-6048000/f1b7b9b44d29f11f9ce6b997ab41bfce.jpg) ,已知该反应的速率公式为
,已知该反应的速率公式为
当[A]0=[B]0=0.01mol·dm-3,在pH=2的条件下,298K时的反应半衰期为1h,若其他条件均不变,在288K时t1/2=2h。试计算在298 K时,
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“有一酸催化反应,已知该反应的速率公式为 当[A]0=[B]0…”相关的问题
更多“有一酸催化反应,已知该反应的速率公式为 当[A]0=[B]0…”相关的问题
第1题
有一酶催化反应 ,设H2O大大过量,溶液的pH=7.1,温度为0.5℃,酶的初始浓度[E]0=2.8×10-9mol·dm-3。实验测得反应初速率r0随CO2(g)的初始浓度[CO2]。的变化如下所示:
,设H2O大大过量,溶液的pH=7.1,温度为0.5℃,酶的初始浓度[E]0=2.8×10-9mol·dm-3。实验测得反应初速率r0随CO2(g)的初始浓度[CO2]。的变化如下所示:
| CO20/(mmol·dm-3) | 1.25 | 2.50 | 5.00 | 20.0 |
| r0/(mmol·dm-3·s-1) | 0.028 | 0.048 | 0.080 | 0.155 |
试求:
第2题
在473K时,有反应A+2B→2C+D,其速率方程可写成r=k[A]x[B]y。实验(1):当A、B的初始浓度分别为[A]0=0.01mol·dm-3和[B]0=0.02mol·dm-3时,测得反应物B在不同时刻的浓度数据如下:
| t/h | 0 | 90 | 217 |
| [B]/(mol·dm-3) | 0.020 | 0.010 | 0.0050 |

第3题
反应2A+B→A2B是一基元反应,某温度时,当两反应物的浓度均为0.01mol·dm-3时,初始反应速率为2.5×10-3mol·dm-3·s-1。当A的浓度为0.015mol·dm-3,B的浓度为0.030mol·dm-3时,初始反应的速率是多少?
第4题
某溶液的反应A+B→P,当A和B的起始浓度为[A]0=1×10-4mol·dm-3,[B]0=0.01mol·dm-3时,实验测得不同温度下吸光度随时间的变化如下表:
| t/min | 0 | 57 | 130 | ∞ |
| 298K时A的吸光度A | 1.39 | 1.030 | 0.706 | 0.100 |
| 308K时B的吸光度A | 1.460 | 0.542 | 0.210 | 0.110 |
当固定[A]0=1×10-4mol·dm-3,改变[B]0时,实验测得在298K时,t1/2随[B]0的变化如下表:
| [B]0/(mol·dm-3) | 0.01 | 0.02 |
| t1/2/s | 120 | 30 |
设速率方程为,r=k[A]α[B]β,试计算α、β、速率常数k和实验活化能Ea。
第5题
有正、逆反应均为一级反应的对峙反应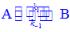 ,已知其速率常数和平衡常数与温度的关系分别为
,已知其速率常数和平衡常数与温度的关系分别为
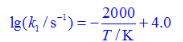
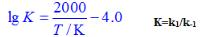 ,
,
反应开始时,[A]0=0.5mol·dm-3,[B]0=0.05mol·dm-3。试计算:
(1)逆反应的活化能;
(2)400k时,反应10s后,A和B的浓度;
(3)400k时,反应达到平衡时,A和B的浓度.
第6题
已知某反应的速率方程可表示为r=k[A]α[B]β[C]γ,请根据下列实验数据,分别确定该反应物的级数α、β、γ的值和计算速率常数k。
| r/(10-3mol·dm-3·s-1) | 5.0 | 5.0 | 2.5 | 14.1 |
| [A]0/(mol·dm-3) | 0.010 | 0.010 | 0.010 | 0.020 |
| [B]0/(mol·dm-3) | 0.005 | 0.005 | 0.010 | 0.005 |
| [C]0/(mol·dm-3) | 0.010 | 0.015 | 0.010 | 0.010 |
第7题
已知电池(-)Cu|Cu2+(0.1mol·dm-3)||Ag+(0.01mol·dm-3)|Ag(),(Cu2+/Cu)=0.3419V,
(Ag+/Ag)=-0.7996V,计算该反应的平衡常数。
第8题
有一浓度均为0.01mol·dm-3的Mn2+、Co2+混合溶液,若通入H2S气体至饱和(已知H2S饱和溶液的浓度为0.1mol·dm-3),在pH=4.0时能否使Mn2+、CO2+分离?


为了保护您的账号安全,请在“赏学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 赏学吧
赏学吧



 微信搜一搜
微信搜一搜
 赏学吧
赏学吧