已知298.15K时PbI2和BaCrO4在水中的溶解度分别为0.76g·L-1和2.9g·L-1计算该温度下PbI2和BaCrO4的标准溶度积常数。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“已知298.15K时PbI2和BaCrO4在水中的溶解度分别…”相关的问题
更多“已知298.15K时PbI2和BaCrO4在水中的溶解度分别…”相关的问题
第1题
根据PbI2的溶度积,计算(在298K时):PbI2在三种 溶液中的溶解度,并对以上计算结果进行分析, (1)PbI2在纯水中的溶解度(mol·dm-3); (2)PbI2在0.010 mol·dm-3 KI 溶液中的溶解度; (3)PbI2在0.010 mol·dm-3 Pb(NO3)2纯水中的溶解度;
第2题
第3题
根据PbI2的溶度积常数,计算在25℃ 时的下列参数: (1)PbI2在水中的溶解度; (2)在PbI2饱和溶液中Pb2+离子和I-离子的浓度; (3)PbI2在浓度为0.010 mol.dm-3的KI溶液中达到饱和时,溶液中的Pb2+离子浓度; (4)PbI2在浓度为0.010 mol.dm-3的Pb(NO3)2溶液中的溶解度。
第4题
计算298K时下述电池的电动势E。
Pb(s)|PbCl2(s)|HCl(0.01mol·kg-1)|H2(10kPa)|Pt
已知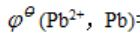 =-0.126V,该温度下PbCl2(s)在水中饱和溶液的浓度为0.039mol·kg-1(用Debye-Huckel极限公式求活度因子后再计算电动势)。
=-0.126V,该温度下PbCl2(s)在水中饱和溶液的浓度为0.039mol·kg-1(用Debye-Huckel极限公式求活度因子后再计算电动势)。
第5题
在20℃,101.325kPa下氨在水中的溶解度约为1:700(体积比),请计算饱和氨溶液的质量摩尔浓度(已知水在20℃时的密度为0.9982063g·cm-3)。
第6题
A.大于
B.小于
C.等于
D.不确定
第7题
已知反应:
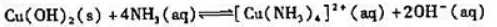
(1)计算该反应在298K下的标准平衡常数;
(2)估算Cu(OH)2在6.0mol·L-1氨水中的溶解度(mol·L-1)(忽略氨水浓度的变化).
第8题
25℃时AgCl在纯水中的溶解度为1.34×10-5mol/L,则该温度下AgCl的Ksp值为()。
A.8.8×10-10
B.5.6×10-10
C.3.5×10-10
D.1.8×10-10
第9题
已知介质的压力p和温度T,在该温度下,当p小于饱和压力pb时,介质所处的状态是()
A.未饱和水
B.饱和水
C.湿节蒸汽
D.过热蒸汽
第10题
已知某温度下CaF2的溶度积为5.3×10-9,求CaF2的溶解度(g.L-1)。M(CaF2)=78.08g.mol-1(1)在纯水中;(2)在0.10mol.L-1NaF溶液中;(3)在0.20mol.L-1 CaCl2溶液中。


为了保护您的账号安全,请在“赏学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 赏学吧
赏学吧



 微信搜一搜
微信搜一搜
 赏学吧
赏学吧