已知:(1)求反应的平衡常数。(2)其他条件不变,分别判断[H+]=10mo/L时、pH=9时反应朝什么方
已知:![已知:(1)求反应的平衡常数。(2)其他条件不变,分别判断[H+]=10mo/L时、pH=9时反应朝](https://img2.soutiyun.com/ask/2020-07-28/9647967156037.png)
(1)求反应![已知:(1)求反应的平衡常数。(2)其他条件不变,分别判断[H+]=10mo/L时、pH=9时反应朝](https://img2.soutiyun.com/ask/2020-07-28/96479649234493.png) 的平衡常数。
的平衡常数。
(2)其他条件不变,分别判断[H+]=10mo/L时、pH=9时反应朝什么方向进行?
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
已知:![已知:(1)求反应的平衡常数。(2)其他条件不变,分别判断[H+]=10mo/L时、pH=9时反应朝](https://img2.soutiyun.com/ask/2020-07-28/9647967156037.png)
(1)求反应![已知:(1)求反应的平衡常数。(2)其他条件不变,分别判断[H+]=10mo/L时、pH=9时反应朝](https://img2.soutiyun.com/ask/2020-07-28/96479649234493.png) 的平衡常数。
的平衡常数。
(2)其他条件不变,分别判断[H+]=10mo/L时、pH=9时反应朝什么方向进行?
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“已知:(1)求反应的平衡常数。(2)其他条件不变,分别判断[…”相关的问题
更多“已知:(1)求反应的平衡常数。(2)其他条件不变,分别判断[…”相关的问题
第2题
已知电极反应:
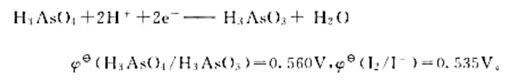
计算下列反应:
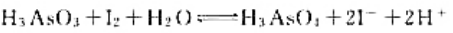
(1)在298K时的平衡常数;
(2)如果pH=7,其他物质浓度均为标准态,反应向什么方向进行?
(3)如果溶液的c(H+)=6.0mol·L-1.其他物质浓度均为标准态.反应向什么方向进行?
第4题
将下面的电池反应用电池行号表示:
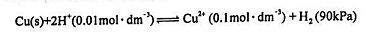
求电池:(1)标准电动势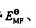 、标准自由能变
、标准自由能变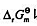 以及反应平衡常数。
以及反应平衡常数。
(2)分别根据EMF和 判断反应从左向右能否自发进行。
判断反应从左向右能否自发进行。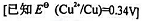
第5题
已知反应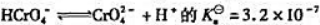 反应
反应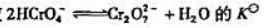 =33.
=33.
(1)计算反应 的标准平衡常数Kθ;
的标准平衡常数Kθ;
(2)计算1.0mol·L-1K2CrO4溶液中CrO42-与Cr2O72-浓度相等时溶液的pH.
第6题
已知室温下反应的平衡常数K=0.40, Cr(OH)3的Ksp=6.3×10-31,求算:
已知室温下反应 的平衡常数K=0.40,
的平衡常数K=0.40,
Cr(OH)3的Ksp=6.3×10-31,求算:
第7题
已知下列电极反应的标准电极电势:
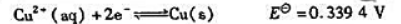
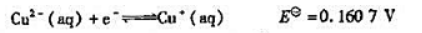
(1)计算反应: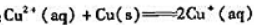 的KΘ;
的KΘ;
(2)已知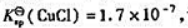 计算反应:
计算反应:
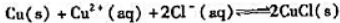 的标准平衡常数KΘ:
的标准平衡常数KΘ:
第8题
对于氧化还原反应BrO3-+5Br-+6H+====3Br2+3H2O。(1)求此反应的平衡常数;(2)计算当溶液的pH=7.0,[BrO3-]=0.10mol/L,[Br-]=0.70mol/L时,游离溴的平衡浓度。
第9题
已知在298K时,下列反应:
①CO2(g)+2NH3(g)===H2O(g)+CO(NH2)2(s),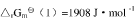
②
③C(石墨)+O2(g)===CO2(g),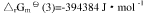
④N2(g)+3H2(g)===2NH3(g),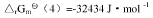 试求:(1)尿素CO(NH2)2(s)的标准摩尔生成Gibbs自由能
试求:(1)尿素CO(NH2)2(s)的标准摩尔生成Gibbs自由能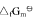 ;(2)由稳定单质生成尿素反应的平衡常数与上列反应平衡常数的关系式;(3)由单质生成尿素反应的平衡常数
;(2)由稳定单质生成尿素反应的平衡常数与上列反应平衡常数的关系式;(3)由单质生成尿素反应的平衡常数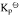 。
。
第10题
已知:Hg2++2e-===Hg Eθ=0.85 V,Hg22++2e-===2Hg Eθ=0.80 V, (1)求反应Hg2++Hg===Hg22+ 的平衡常数Kθ; (2)求0.10 mol.L-1Hg2(NO3)2溶液中Hg2+的浓度(25℃)。
第11题
已知电对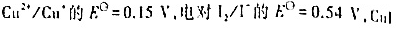 的
的
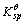 =1.3×10-12。
=1.3×10-12。
(1)试求氧化还原反应
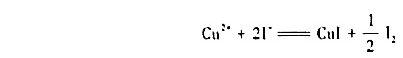
298K时的平衡常数;
(2)若溶液中Cu2+的起始浓度为0.10 mol·dm-3,I-的起始浓度为1.0 mol·dm-3,试计算达到平街时留在溶液中Cu2+的浓度。


为了保护您的账号安全,请在“赏学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 赏学吧
赏学吧



 微信搜一搜
微信搜一搜
 赏学吧
赏学吧