题目内容
(请给出正确答案)
[主观题]
试计算0.10mol•L-1Fe3+开始沉淀和沉淀完全时溶液的pH值。(已知Fe(OH)3的KSP=1.1×10-36)
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“试计算0.10mol•L-1Fe3+开始沉淀和沉淀完全时溶液…”相关的问题
更多“试计算0.10mol•L-1Fe3+开始沉淀和沉淀完全时溶液…”相关的问题
第2题
已知

第3题
第5题
已知H2CO3的

第7题
300K时,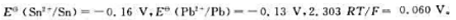 试计算Sn2+浓度为0.10mol·L-1Pb浓度为1.0×10-3mol·L-1时下列氧化还原反应进行的方向:
试计算Sn2+浓度为0.10mol·L-1Pb浓度为1.0×10-3mol·L-1时下列氧化还原反应进行的方向:

第8题
25℃时二元弱酸H2B的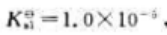
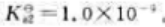
试计算:
(1)25℃时0.10mol·L-1H2B溶液的pH;
(2)25℃时0.10mol·L-1NaHB溶液的pH;
(3)25℃时0.10mol·L-1.H2B0.010mol·L-1NaHB混合溶液的pH:
(4)25℃时0.10mol·L-1Na2B溶液的pH。
第9题
25℃时,一元弱酸HA的标准解离常数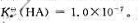 试计算0.10mol·L-1HA溶液的pH和HA的解离度。
试计算0.10mol·L-1HA溶液的pH和HA的解离度。
第10题
在常温常压下,H2S气体在水中的饱和浓度约为0.10mol·L-1,试计算该溶液中H+、H2S、HS-、S2-的平衡浓度。
第11题
在1.0L某溶液中,含有HAc和HCN各0.10mol,试计算该溶液中c(H+),c(Ac-)和c(CN-)各为多少?(已知:



为了保护您的账号安全,请在“赏学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 赏学吧
赏学吧



 微信搜一搜
微信搜一搜
 赏学吧
赏学吧