题目内容
(请给出正确答案)
[主观题]
338K时,N2O5 (g)气相分解反应的速率常数为0.292 min-1,活化能为103.3 kJ•mol-1。求353K时该反应的速率常数及半衰期。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“338K时,N2O5 (g)气相分解反应的速率常数为0.29…”相关的问题
更多“338K时,N2O5 (g)气相分解反应的速率常数为0.29…”相关的问题
第1题
第2题
30. 65℃时N2O5气相分解的速率常数为0.292min-1,活化能为103.3kJ·mol-1,求80℃时的k和t1/2。
第3题
65℃时进行反应N2O5(g)=N2O4(g)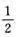 +O2(g),测得N2O5的分解速率常数为0.292min-1,反应的活化能为103kJ·mol-1,计算15℃时此反应的k及t1/2.
+O2(g),测得N2O5的分解速率常数为0.292min-1,反应的活化能为103kJ·mol-1,计算15℃时此反应的k及t1/2.
第6题
第7题
第8题
第9题
A.40
B.21.66
C.20
D.27.72
第10题
A.0.4
B.0.57
C.1.0
D.0.5


为了保护您的账号安全,请在“赏学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 赏学吧
赏学吧



 微信搜一搜
微信搜一搜
 赏学吧
赏学吧