计算在1mol·L-1H2SO4介质中,用KMnO4滴定Fe2+的条件平衡常数及化学计量点的反应进行程度。(已知:=1.45V,=0.68
计算在1mol·L-1H2SO4介质中,用KMnO4滴定Fe2+的条件平衡常数及化学计量点的反应进行程度。(已知:MnO 4- /Mn 2+电极电位=1.45V,Fe 3+ /Fe 2+电极电位=0.68V)
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
计算在1mol·L-1H2SO4介质中,用KMnO4滴定Fe2+的条件平衡常数及化学计量点的反应进行程度。(已知:MnO 4- /Mn 2+电极电位=1.45V,Fe 3+ /Fe 2+电极电位=0.68V)
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“计算在1mol·L-1H2SO4介质中,用KMnO4滴定Fe…”相关的问题
更多“计算在1mol·L-1H2SO4介质中,用KMnO4滴定Fe…”相关的问题
第1题
计算在1mol•L-1H2SO4及1mol•L-1H2SO4+0.5mol•L-1H3PO4介质中Ce4+滴定Fe2+,用二苯胺磺酸钠(NaIn)为指示剂时,终点误差各为多少?
已知在1mol•L-1H2SO4中:Ce4+/Ce3+的
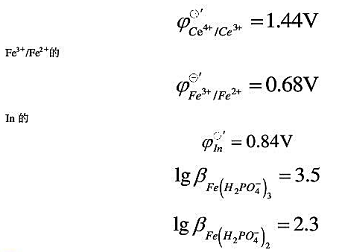
第2题
第3题
计算在1,10-邻二氮菲存在下,溶液含H2SO4浓度为1mol.L-1时,Fe3+/Fe2+电对的条件电势。(忽略离子强度的影响。已知在1mol·L-1H2SO4溶液中,亚铁络合物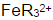 与高铁络合物
与高铁络合物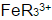 的稳定常数之比KⅡ/KⅢ=2.8×106。)
的稳定常数之比KⅡ/KⅢ=2.8×106。)
第5题
下列体系电位滴定至化学计量点时的电池电动势(用SCE作负极)为多少?
(a)在1mol·L-1HCL介质中,用Ce4+滴定Sn2+;
(b)在1mol·L-1H2SO4介质中,用Fe3+滴定UIV;
(c)在lmol·L-1H2SO4介质中,用Ce4+滴定vo2+.
第6题
已知在1mol•L-1H2SO4介质中,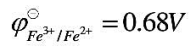 ,1,10-邻二氮菲与Fe3+、Fe2+均能形成配位化合物,加入1,10-邻二氮菲后,体系的条件电势变为1.06V。试问Fe3+与Fe2+和1,10-邻二氮菲形成的配位化合物中,哪一种更稳定?
,1,10-邻二氮菲与Fe3+、Fe2+均能形成配位化合物,加入1,10-邻二氮菲后,体系的条件电势变为1.06V。试问Fe3+与Fe2+和1,10-邻二氮菲形成的配位化合物中,哪一种更稳定?
第7题
计算在溶液中c(

第8题
第9题
计算在1mol·L-1HCl溶液中,下述反应的条件平衡常数:
2Fe3++3I-====2Fe2++
当20mL0.10mol·L-1Fe3+与20mL0.30mol·L-1I-混合后,溶液中残留的Fe3+还有百分之几?如何才能做到定量地测定Fe3+?(已知:



为了保护您的账号安全,请在“赏学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 赏学吧
赏学吧



 微信搜一搜
微信搜一搜
 赏学吧
赏学吧