计算在1mol·L-1HCl溶液中,用Fe3+滴定Sn2+时,化学计量点的电势,并计算滴定至99.9%和100.1%时的电势。说明为什
计算在1mol·L-1HCl溶液中,用Fe3+滴定Sn2+时,化学计量点的电势,并计算滴定至99.9%和100.1%时的电势。说明为什么化学计量点前后,同样改变0.1%,电势的变化不相同。若用电位滴定判断终点,与计算所得化学计量点电势一致吗?(

 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
计算在1mol·L-1HCl溶液中,用Fe3+滴定Sn2+时,化学计量点的电势,并计算滴定至99.9%和100.1%时的电势。说明为什么化学计量点前后,同样改变0.1%,电势的变化不相同。若用电位滴定判断终点,与计算所得化学计量点电势一致吗?(

 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“计算在1mol·L-1HCl溶液中,用Fe3+滴定Sn2+时…”相关的问题
更多“计算在1mol·L-1HCl溶液中,用Fe3+滴定Sn2+时…”相关的问题
第1题
计算在1mol·L-1HCl溶液中用Fe3+滴定Sn2+的电势突跃范围。在此滴定中应选用什么指示剂?若用所选指示剂,滴定终点是否和化学计量点符合?
第2题
计算在1mol·L-1HCl溶液中,用Fe3+滴定Sn2+时化学计量点的电势,并计算滴定至99.9%和100.1%时的电势。说明为什么化学计量点前后,同样改变0.1%,电势的变化不相同。若用电势滴定判断终点,与计算所得化学计量点电势一致吗?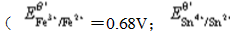
第3题
第4题
计算在1mol·L-1HCl溶液中,下述反应的条件平衡常数:
2Fe3++3I-====2Fe2++
当20mL0.10mol·L-1Fe3+与20mL0.30mol·L-1I-混合后,溶液中残留的Fe3+还有百分之几?如何才能做到定量地测定Fe3+?(已知:

第6题
计算在溶液中c(

第8题
第9题
A.0.1mol•L-1HCl溶液
B.
0.1mol•L-1NH3•H2O
C.
0.1mol•L-1HAc溶液
D.
1mol•L-1HAc+1mol•L-1NaAc溶液
第10题
计算在1mol•L-1H2SO4及1mol•L-1H2SO4+0.5mol•L-1H3PO4介质中Ce4+滴定Fe2+,用二苯胺磺酸钠(NaIn)为指示剂时,终点误差各为多少?
已知在1mol•L-1H2SO4中:Ce4+/Ce3+的
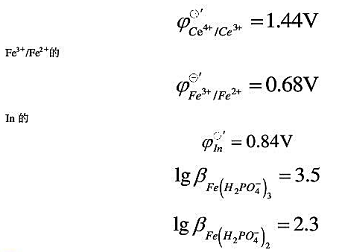


为了保护您的账号安全,请在“赏学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 赏学吧
赏学吧



 微信搜一搜
微信搜一搜
 赏学吧
赏学吧