在298K时,用Ag|AgCl为电极,电解KCl的水溶液,通电前溶液中KCl的质量分数为ω(KCl)=1.4941×10-3,通电后在质量
在298K时,用Ag|AgCl为电极,电解KCl的水溶液,通电前溶液中KCl的质量分数为ω(KCl)=1.4941×10-3,通电后在质量为120.99g的阴极部溶液中ω(KCl)=1.9404×10-3,串联在电路中的银库仑计中有160.24mg的Ag沉积出来,求K+和Cl-的迁移数。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
在298K时,用Ag|AgCl为电极,电解KCl的水溶液,通电前溶液中KCl的质量分数为ω(KCl)=1.4941×10-3,通电后在质量为120.99g的阴极部溶液中ω(KCl)=1.9404×10-3,串联在电路中的银库仑计中有160.24mg的Ag沉积出来,求K+和Cl-的迁移数。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“在298K时,用Ag|AgCl为电极,电解KCl的水溶液,通…”相关的问题
更多“在298K时,用Ag|AgCl为电极,电解KCl的水溶液,通…”相关的问题
第1题
已知298K时,E(Ag+|Ag)=0.7991V.E(Ag+|AgCl(s)|Ag)=0.2221V.请:
(1)用这两个电极组成可发电的电池.写出该电池的电池表示式,电极反应及电池反应:
(2)当电池可逆地输出2mol电子的电量时,求电池反应的ΔtGmθ
(3)求298K时AgCl(s)的溶度积.
第2题
第3题
在298K时,有电池:Ag(s)|AgCl(s)|NaCl(aq)|Hg2Cl2(s)|Hg(l)。已知化合物的标准生成Gibbs自由能分别为

第4题
第5题
电池Ag(s)|AgCl(s)|KCl(m)|Hg2Cl2(s)|Hg(l)的电池反应为
Ag(s)+1/2Hg2Cl2(s)→AgCl(s)+Hg(l)
已知298K时,此电池反应的焓变△rHm为5435J/mol,各物质的规定熵数据为
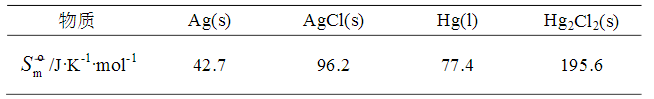 试计算该温度下电池的电动势E及电池电动势的温度系数
试计算该温度下电池的电动势E及电池电动势的温度系数 。
。
第6题
请:
(1)写出电极反应和电池反应;
(2)求正极Cl-(0.1mol·kg-1,γ±=0.798)|AgCl(s)IAg(s)的标准电极电势:
(3)求电池反应H2(g)+2AgCl(s)→2Ag(s)+2HCl的标准平衡常数.
第7题
用电动势法测定丁酸的解离常数。在298K时安排成如下电池:
Pt|H2(p。)|HA(m1),NaA(m2),NaCl(m3)|AgCl(s)|Ag(s)
其中HA为丁酸,NaA为丁酸钠。实验数据如下:
| m1/(mol·kg-1) | m2/(mol·kg-1) | m3/(mol·kg-1) | E/V |
| 0.00717 | 0.00687 | 0.00706 | 0.63387 |
| 0.01273 | 0.01220 | 0.01254 | 0.61922 |
| 0.01515 | 0.01453 | 0.01493 | 0.61501 |
试求HA==H++A-的平衡常数Kθ。设活度因子均为1。
第8题
Ag-|Ag和CI-|AgCl(s)|Ag在298K时的标准电极电势分别为0.7991V和0.2224V。(1)计算AgCl在水中的饱和溶液的浓度;(2)用Debye -Huckel极限公式计算298 K时AgCl在0.0lmol·kg-1KNO3溶液中的饱和浓度,已知A=0.509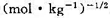 ;(3)计算反应AgCl(s)-- -
;(3)计算反应AgCl(s)-- - 。
。
第9题
在298K和标准压力下,当电流密度为0.1A·cm-2时,H2(g)和O2(g)在Ag(s)电极上的超电势分别为0.87V和0.98V。今用Ag(s)电极电解浓度为0.01mol·kg-1的NaOH溶液,问这时在两个银电极上首先发生什么反应?此时外加电压为多少(设活度因子为1)?
第10题
298K时,在Ag+/Ag电极中加入过量I-,设达到平衡时c(I-)=0.1mol·dm-3,而另一电极为Cu2+/Cu,c(Cu2+)=0.01mol·dm-3,将两电极组成原电池,写出原电池符号、电池反应,并求电池反应平衡常数。
已知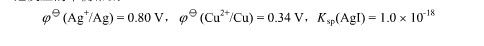


为了保护您的账号安全,请在“赏学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 赏学吧
赏学吧



 微信搜一搜
微信搜一搜
 赏学吧
赏学吧