在308K和总压1.013x105Pa,N2O4有27.2%分解为NO2。(1)计算反应的;(2)计算308K时总压为2.026x105P
在308K和总压1.013x105Pa,N2O4有27.2%分解为NO2。
(1)计算 反应的
反应的 ;
;
(2)计算308K时总压为2.026x105Pa时,N2O4的离解百分率;
(3)从计算结果说明压强对平衡移动的影响。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
在308K和总压1.013x105Pa,N2O4有27.2%分解为NO2。
(1)计算 反应的
反应的 ;
;
(2)计算308K时总压为2.026x105Pa时,N2O4的离解百分率;
(3)从计算结果说明压强对平衡移动的影响。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“在308K和总压1.013x105Pa,N2O4有27.2%…”相关的问题
更多“在308K和总压1.013x105Pa,N2O4有27.2%…”相关的问题
第1题
在308K和总压100kPa时,N2O4有27.2%分解为NO2。
(1)计算N2O4(g)==2NO2(g)反应的Kp;
(2)计算308K和总压2.026×105Pa时,N2O4的解离百分率;
(3)从计算结果说明压力对平衡移动的影响。
第3题
某溶液中含有NaOH及CH3COOC2H5,浓度均为0.01mol·dm-3。在298K时,反应10min有39%的CH3COOC2H5分解,而在308K时,反应10min有55%的CH3COOC2H5分解。试计算;
(1)该反应的活化能
(2)288K时,10分钟能分解多少?
(3)293k时,若有50%的CH3COOC2H5分解需时多少?
第4题
反应NH4HS(s)=NH3(g)+H2S(g)的ΔrHmθ=94kJ·mol-1,ΔCp=0.298K时NH4HS(s)的分解压力为6.08X104Pa,(1)试计算308K时,NH4HS(s>的分解压力;(2>若将各为0.6mol的H2S(g)和NHa(g)放人20dm3容器中,试计算308K时生成NH4HS(s)为多少?
第5题
第6题
100℃时下列反应的Kθ=8.1×10-9,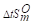 =125.6J·mol·K-1.计算:
=125.6J·mol·K-1.计算:
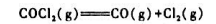
(1)100℃,总压为200KPa时COCl2的解离度;
(2)100℃下上述反应的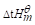 ;
;
(3)总压为200kPa,COCl2的解离度为0.1%时的温度,设ΔTGp,m=0.
第7题
乙茉脱氢制烯:
分别计算下列情况时乙辈的平衡转化率:
(1)总压为100kPa时;
(2)总压为1000kPa时;
(3)总压为100kPa,但原料气中水蒸气与乙笨蒸气的摩尔比为10:1.
第8题
在373K下,反应:COCl2(g)
 CO(g)+Cl2(g)的K=8×10,△S373=125.5J/K。 计算:(1)373K,总压为202.6kPa时COCl2的解离度; (2)373K下上述反应的△H; (3)总压为202.6kPa,COCl2的解离度为0.1%时的温度,设△Cp=0。
CO(g)+Cl2(g)的K=8×10,△S373=125.5J/K。 计算:(1)373K,总压为202.6kPa时COCl2的解离度; (2)373K下上述反应的△H; (3)总压为202.6kPa,COCl2的解离度为0.1%时的温度,设△Cp=0。
第9题
某基元反应A(g)+B(g)→P(g),设在298K时的速率常数kp(298K)=2.777×10-5Pa-1·s-1;308K时,kp(308K)=5.55×10-5Pa-1·s-1。若A(g)和B(g)的原子半径和摩尔质量分别为rA=0.36nm,rB=0.41nm,MA=28g·mol-1,MB=71g·mol-1。试求在298K时,
1)
该反应的概率因子
P
;
(2)
反应的活化焓
△
r
*
H
m
,活化熵
△
r
*
S
m
和活化
Gibbs
自由能
△
r
*
G
m
。

第10题
在585K和总压为100kPa时,有56.4%NOCI(g)按下式分解: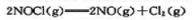 。
。
若未分解时NOCI的量为1mol。计算(1)平衡时各组分的物质的量; (2)各组分的平衡分压;(3)该温度时的K。
第11题
在373K下,反应:COCI2(g)===CO(g)+Cl2(g)的Kp=8×109,ΔSƟ373=125.5J/K。
计算:(1)373K,总压为202.6kPa时COCl2的解离度;
(2)373K下上述反应的ΔHƟ:
(3)总压为200kPa,COCl2的解离度为0.1%时的温度,设ΔCp=0。


为了保护您的账号安全,请在“赏学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 赏学吧
赏学吧



 微信搜一搜
微信搜一搜
 赏学吧
赏学吧