已知Eθ(Cd2+/Cd)=一0.40 V,Eθ(Zn2+/Zn)=一0.76 V,计算下列电池:Zn | Zn2+(0.010 mol.L-1)‖Cd2+(0
已知Eθ(Cd2+/Cd)=一0.40 V,Eθ(Zn2+/Zn)=一0.76 V,计算下列电池:Zn | Zn2+(0.010 mol.L-1)‖Cd2+(0.050 mol.L-1)| Cd的Eθ,△r2Gspθ,及E,△rGm数值,写出该电池表示的反应式。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
已知Eθ(Cd2+/Cd)=一0.40 V,Eθ(Zn2+/Zn)=一0.76 V,计算下列电池:Zn | Zn2+(0.010 mol.L-1)‖Cd2+(0.050 mol.L-1)| Cd的Eθ,△r2Gspθ,及E,△rGm数值,写出该电池表示的反应式。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“已知Eθ(Cd2+/Cd)=一0.40 V,Eθ(Zn2+/…”相关的问题
更多“已知Eθ(Cd2+/Cd)=一0.40 V,Eθ(Zn2+/…”相关的问题
第1题
A.铁粉、镉粉皆会溶解
B.铁粉、镉粉皆不会溶解
C.铁粉溶解,镉粉不溶解
D.铁粉不溶解
第2题
A.铁粉、镉粉皆会溶解
B.铁粉、镉粉皆不会溶解
C.铁粉溶解,镉粉不溶解
D.铁粉不溶解
第3题
A.铁粉、镉粉皆会溶解
B.铁粉、镉粉皆不会溶解
C.铁粉溶解,镉粉不溶解
D.铁粉不溶解
第4题
已知

Cd|Cd2+(0.10mol·L-1)||Sn4+(0.10mol·L-1),Sn2+(0.0010mol·L-1)|Pt在298K时的电动势ε,并写出电池反应,标明正、负极。
第5题
试为下述反应设计一电池
Cd(s)+I2(s)====Cd2+(a=1)+2I-(a=1)
求电池在298K时的标准电动势E、反应的△rG和平衡常数Kθ。
第6题
第7题
已知Cd2+的一级水解反应:Cd2++H2O=Cd(OH)++H+的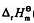 (298.15K)=
(298.15K)=
60.00kJ·mol-1; (98.15K)= 20.00J·mol-1·K-1。(1)求 298.15K时,Cd2+的一级水解反应的标准解离平衡常数;(2)0.1mol·dm-3的Cd(NO3)2水溶液的pH。
(98.15K)= 20.00J·mol-1·K-1。(1)求 298.15K时,Cd2+的一级水解反应的标准解离平衡常数;(2)0.1mol·dm-3的Cd(NO3)2水溶液的pH。
第8题
用电解沉积的办法分离Cd2+和Zn2+,已知H2在Cd上的超电势为0.48V,在Zn上的超电势为0.70V,溶液中的Cd2+和Zn2+浓度皆为0.1mol/kg。(已知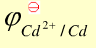 =-0.403V,
=-0.403V,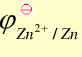 =-0.763V,离子的活度系数均为1,溶液的pH保持中性。)通过计算回答下面的问题:
=-0.763V,离子的活度系数均为1,溶液的pH保持中性。)通过计算回答下面的问题:
第9题
已知Cd2+的一级水解反应:Cd2++H2O=Cd(OH)++H+的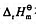 在298.15K为60kJ·mol-1,
在298.15K为60kJ·mol-1,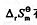 在298.15K为20J·mol-1·K-1。试求298.15K时,此水解反应的标准平衡常数以及0.10mol·dm-3的Cd(NO3)2溶液的pH[设Cd(NO3)2在水溶液中完全电离或解离]。
在298.15K为20J·mol-1·K-1。试求298.15K时,此水解反应的标准平衡常数以及0.10mol·dm-3的Cd(NO3)2溶液的pH[设Cd(NO3)2在水溶液中完全电离或解离]。
第10题
已知溶液中Cd2+和Zn2+浓度均为0.1mol.kg-1,H2在Pt、Cd和Zn上的超电势分别为0.12V、0.48V和0.70V。问25℃时能否用Pt作为电极以电解沉积Cd2+的方法来分离溶液中的Cd2+和Zn2+?已知25℃时,
1.jpg) 假设电解过程中保持溶液的pH=7,析出的H2(g)压力为100kPa。
假设电解过程中保持溶液的pH=7,析出的H2(g)压力为100kPa。


为了保护您的账号安全,请在“赏学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 赏学吧
赏学吧



 微信搜一搜
微信搜一搜
 赏学吧
赏学吧