在298K和标准压力下,用铁Fe(s)为阴极,C(石墨)为阳极,电解6.0mol·kg-1的NaCl水溶液。若H2(g)在铁阴极上的超电
在298K和标准压力下,用铁Fe(s)为阴极,C(石墨)为阳极,电解6.0mol·kg-1的NaCl水溶液。若H2(g)在铁阴极上的超电势为0.20V,O2(g)在石墨阳极上的超电势为0.60V,Cl2(g)的超电势可忽略不计,试说明两极上首先发生的反应及计算至少需加多少外加电压,电解才能进行(设活度因子均为1)。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
在298K和标准压力下,用铁Fe(s)为阴极,C(石墨)为阳极,电解6.0mol·kg-1的NaCl水溶液。若H2(g)在铁阴极上的超电势为0.20V,O2(g)在石墨阳极上的超电势为0.60V,Cl2(g)的超电势可忽略不计,试说明两极上首先发生的反应及计算至少需加多少外加电压,电解才能进行(设活度因子均为1)。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“在298K和标准压力下,用铁Fe(s)为阴极,C(石墨)为阳…”相关的问题
更多“在298K和标准压力下,用铁Fe(s)为阴极,C(石墨)为阳…”相关的问题
第1题
在298K和标准压力下,当电流密度为0.1A·cm-2时,H2(g)和O2(g)在Ag(s)电极上的超电势分别为0.87V和0.98V。今用Ag(s)电极电解浓度为0.01mol·kg-1的NaOH溶液,问这时在两个银电极上首先发生什么反应?此时外加电压为多少(设活度因子为1)?
第2题
在298K和标准压力下,用电解沉积法分离Cd2+、Zn2+混合溶液。已知Cd2+和Zn2+的浓度均为0.10mol·kg-1(设活度因子均为1),H2(g)在Cd(s)和Zn(s)上的超电势分别为0.48V和0.70V,设电解液的pH值保持为7.0。试问:

第3题
通过计算说明在298.15K、标准压力下,用C还原Fe2O3生成Fe和CO2在热力学上是否可能?若要反应自发进行,温度最低为多少?已知298.15K时相关热力学数据如下:
3C(石墨)+2Fe2O3(s)====4Fe(s)+3CO2(g)

第4题
在298K和标准压力下,用电解沉积法分离Cd2+、Zn2+混合溶液。已知Cd2+和Zn2+的浓度均为0.10 mol·kg-1(设活度因子均为1),H2(g)在Cd(s)和Zn(s)上的超电势分别为0.48 V和0.70V,设电解液的pH值保持为7.0。试问:(1)阴极上首先析出何种金属? (2)第二种金属析出时第一种析出的离子的残留浓度为多少?(3)氢气是否有可能析出而影响分离效果?
第5题
根据下列在298K和标准压力下的热力学数据,计算HgO(s)在该温度时的解离压。
(1)电池Pt|H2(PH2) |NaOH(a) |HgO(s) |Hg(I)的标准电动势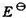 =0.9265V;
=0.9265V;
(2)反应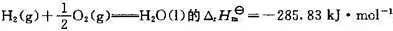 ;
;
(3)298K时,下表为各物质的标准摩尔熵值:

第6题
第7题
298K时,反应H2(g)+Ag2O(s)====2Ag(s)+H2O(l)的恒容热效应QV=-252.79kJ·mol-1。在298K、标准压力下,将上述反应体系构成一可逆原电池,则其电动势的温度系数为-5.044×10-4V·K-1。求Ag(s)|Ag2O(s)|OH-电极的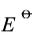 。已知298K时水的离子积Kw=1×10-14。
。已知298K时水的离子积Kw=1×10-14。
第8题
为40.0kPa的H2S,平衡后测得系统总压为77.8kPa;同样条件下,若将NH4HS(s)换成NH4Cl(s),平衡后测得系统总压为50.6kPa.试求:
(1)298K下两个分解反应的标准平衡常数和分解压力.
(2)298K下,将过量NH4HS(s)和NH4CI(s)同时置于抽空密闭容器中,达平衡时反应系统的总压.假设这两种盐类不形成固溶体.
第9题
银可能受H2S气体的腐蚀而发生下列反应
H2S(g)+2Ag(s)→Ag2S(s)+H2(g)
已知在298K和100kPa压力下,Ag2S(s)和H2s(g)的标准生成Gibbs自由能 分别为-40.26kJ·mol-1和-33.02kJ·mol-1。试问在298K和100kPa压力下,
分别为-40.26kJ·mol-1和-33.02kJ·mol-1。试问在298K和100kPa压力下,
(1)在H2S(g)和H2(g)的等体积的混合气体中,Ag是否会被腐蚀生成Ag2S(s)?
(2)在H2S(g)和H2(g)的混合气体中,H2S(g)的摩尔分数低于多少时便不至于使Ag被腐蚀?
第10题


为了保护您的账号安全,请在“赏学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 赏学吧
赏学吧



 微信搜一搜
微信搜一搜
 赏学吧
赏学吧