在970K下,反应起始时N2O的压力为2.93X104Pa,并测得反应过程中系统的总压变化如下表所
在970K下,反应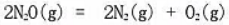 起始时N2O的压力为2.93X104Pa,并测得反应过程中系统的总压变化如下表所示:求最初300s与最后2000s的时间间隔内的平均速率。
起始时N2O的压力为2.93X104Pa,并测得反应过程中系统的总压变化如下表所示:求最初300s与最后2000s的时间间隔内的平均速率。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
在970K下,反应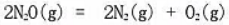 起始时N2O的压力为2.93X104Pa,并测得反应过程中系统的总压变化如下表所示:求最初300s与最后2000s的时间间隔内的平均速率。
起始时N2O的压力为2.93X104Pa,并测得反应过程中系统的总压变化如下表所示:求最初300s与最后2000s的时间间隔内的平均速率。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“在970K下,反应起始时N2O的压力为2.93X104Pa,…”相关的问题
更多“在970K下,反应起始时N2O的压力为2.93X104Pa,…”相关的问题
第1题
N2O(g)的热分解反应2N2O(g)====2N2(g)+O2(g),在一定温度下,反应的半衰期与起始压力成反比。在970K时,N2O(g)的起始压力为39.2kPa,测得半衰期为1529s;在1030K时,N2O(g)的起始压力为48.0kPa,测得半衰期为212s。求:

第2题
N2O(g)的热分解反应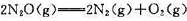 ,在一定温度下,反应的半衰期与起始压力成反比。在970 K时,N2O(g)的起始压力为39.2 kPa,测得半衰期为1529s;在1030K时,N2O(g)的起始压力为48.0 kPa,测得半衰期为212s. (1)判断该反应的级数;(2)计算两个温度下的速率常数;(3)求反应的实验活化能;(4)在1030K时,当N2O(g)的初始压力为53.3kPa时,计算,总压力达到64.0kPa所需的时间。
,在一定温度下,反应的半衰期与起始压力成反比。在970 K时,N2O(g)的起始压力为39.2 kPa,测得半衰期为1529s;在1030K时,N2O(g)的起始压力为48.0 kPa,测得半衰期为212s. (1)判断该反应的级数;(2)计算两个温度下的速率常数;(3)求反应的实验活化能;(4)在1030K时,当N2O(g)的初始压力为53.3kPa时,计算,总压力达到64.0kPa所需的时间。
第3题
N2O(g)的 热分解反应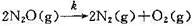 ,从实验测出不同温度时,各个起始压力po与半衰期t1/2的值如下:
,从实验测出不同温度时,各个起始压力po与半衰期t1/2的值如下:
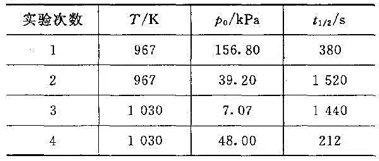
试求:(1)反应级数和不同温度下的速率常数; (2)反应的实验活化能E,值;(3)若1 030 K时,N2O(g)的初始压力为54.00kPa,当压力达到64.00kPa时,所需的时间。
第4题
N2O(g)的热分解反应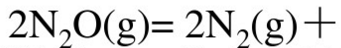
 ,从实验测出不同温度时,各个起始压力p0与半衰期t1/2的值如下:
,从实验测出不同温度时,各个起始压力p0与半衰期t1/2的值如下:
| 实验次数 | T/K | p0/kPa | t1/2/s |
| 1 | 967 | 156.80 | 380 |
| 2 | 967 | 39.20 | 1520 |
| 3 | 1030 | 7.07 | 1440 |
| 4 | 1030 | 48.00 | 212 |
试求:
第5题

(1)计算在两种温度时的k值,用mol-1·dm3·S-1表示:
(2)计算反应的活化能Ea;
(3)计算694℃时的指前因子A.
第6题
第7题
在448~688K的温度区间内,用分光光度法研究了下面的气柑反应:
I2+环戊烯 2HI+环戊二烯,得到KƟp与温度(K)的关系为:
2HI+环戊二烯,得到KƟp与温度(K)的关系为: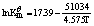
(1)计算在573K时。反应的ΔrGƟm,ΔrHƟm温和ΔrSƟm。.
(2)若开始时用等量的I2和环戊烯混合;温度为573K,起始总压为100kPa,试求平衡后I2的分压。
(3)若起始压力为1000kPa.试求平衡后I2的分压。
第8题
在448~688K的温度区间内,用分光光度法研究了下面的气相反应:I2+环戊烯
 2HI+环戊二烯,得到KpΘ与温度(K)的关系为:lnKpΘ=17.39一
2HI+环戊二烯,得到KpΘ与温度(K)的关系为:lnKpΘ=17.39一
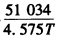 (1)计算在573K时,反应的△rGmΘ、△rHmΘ和△rSmΘ。 (2)若开始时用等量的12和环戊烯混合,温度为573K,起始总压为100kPa,试求平衡后12的分压。 (3)若起始压力为1000kPa,试求平衡后I2的分压。
(1)计算在573K时,反应的△rGmΘ、△rHmΘ和△rSmΘ。 (2)若开始时用等量的12和环戊烯混合,温度为573K,起始总压为100kPa,试求平衡后12的分压。 (3)若起始压力为1000kPa,试求平衡后I2的分压。
第9题


为了保护您的账号安全,请在“赏学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 赏学吧
赏学吧



 微信搜一搜
微信搜一搜
 赏学吧
赏学吧