已知,用两个电极组成原电池,电池符号为,在298. 15K,原电池:的电动势为0.50 V,锌电极的电极电势
已知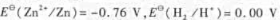 ,用两个电极组成原电池,电池符号为
,用两个电极组成原电池,电池符号为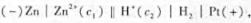 ,在298. 15K,原电池:的电动势为0.50 V,锌电极的电极电势为-0.80 V, 则锌电极中锌离子的浓度c1=()Mol· L-1,氢电极的电极电势E(H2/H+)=()。 氢半电池中氢离子的浓度c2=()mol· L-1,氢半电池中溶液的pH=().该氧化还原反应达到平衡时,反应的
,在298. 15K,原电池:的电动势为0.50 V,锌电极的电极电势为-0.80 V, 则锌电极中锌离子的浓度c1=()Mol· L-1,氢电极的电极电势E(H2/H+)=()。 氢半电池中氢离子的浓度c2=()mol· L-1,氢半电池中溶液的pH=().该氧化还原反应达到平衡时,反应的 。
。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
已知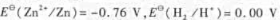 ,用两个电极组成原电池,电池符号为
,用两个电极组成原电池,电池符号为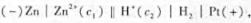 ,在298. 15K,原电池:的电动势为0.50 V,锌电极的电极电势为-0.80 V, 则锌电极中锌离子的浓度c1=()Mol· L-1,氢电极的电极电势E(H2/H+)=()。 氢半电池中氢离子的浓度c2=()mol· L-1,氢半电池中溶液的pH=().该氧化还原反应达到平衡时,反应的
,在298. 15K,原电池:的电动势为0.50 V,锌电极的电极电势为-0.80 V, 则锌电极中锌离子的浓度c1=()Mol· L-1,氢电极的电极电势E(H2/H+)=()。 氢半电池中氢离子的浓度c2=()mol· L-1,氢半电池中溶液的pH=().该氧化还原反应达到平衡时,反应的 。
。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“已知,用两个电极组成原电池,电池符号为,在298. 15K,…”相关的问题
更多“已知,用两个电极组成原电池,电池符号为,在298. 15K,…”相关的问题
第1题
任何电极电势绝对值都不能直接测定,在理论上,某电对的标准电极电势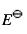 是将其与______电极组成原电池测定该电池的电动势而得到的电极电势的相对值。在实际测定中常以______电极为参比电极,与待测电极组成原电池测定之。
是将其与______电极组成原电池测定该电池的电动势而得到的电极电势的相对值。在实际测定中常以______电极为参比电极,与待测电极组成原电池测定之。
第2题
有一原电池,其电池符号为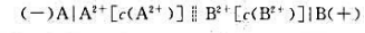 当c(A2+)=c(B2+)时,原电池的电动势为0.78V。现使上述原电池的电动势减小到原来的1/2,求此时两个电极中A2+浓度与B2+浓度的比
当c(A2+)=c(B2+)时,原电池的电动势为0.78V。现使上述原电池的电动势减小到原来的1/2,求此时两个电极中A2+浓度与B2+浓度的比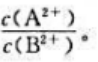
第5题
将下列化学反应写成两个电极反应,查表求出其电极电势值并计算原电池的电动势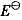 ,再计算电池反应的
,再计算电池反应的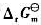 。
。

第6题
由标准钴电极(Co2+/Co)与标准氯电极组成原电池,测得其电动势为1.64V,此时钴电极为负极。已知 (Cl2/Cl-)=1.36V。问:(1) 标准钴电极的电极电势为多少(不查表)?(2) 此电池反应的方向如何?(3) 当氯气的压力增大或减小时,原电池的电动势将发生怎样的变化?(4) 当Co2+的浓度降低到0.010mol·dm-3时,原电池的电动势将发生怎样的变化?数值是多少?
(Cl2/Cl-)=1.36V。问:(1) 标准钴电极的电极电势为多少(不查表)?(2) 此电池反应的方向如何?(3) 当氯气的压力增大或减小时,原电池的电动势将发生怎样的变化?(4) 当Co2+的浓度降低到0.010mol·dm-3时,原电池的电动势将发生怎样的变化?数值是多少?
第7题
(1)写出下列各电对的电极反应式,并根据元素电势图给出各电极反应的标准电极电势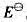 。
。
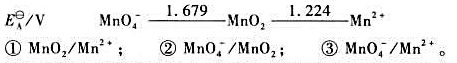
(2)试写出以电对①为负极、电对②为正极的原电池的电池反应,并计算原电池的标准电动势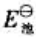 和电池反应的
和电池反应的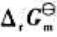 。
。
(3)试写出以电对①为负极、电对③为正极的原电池的电池反应,并计算原电池的标准电动势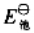 和电池反应的
和电池反应的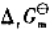 。
。
第8题
由镍电极和标准氢电极组成原电池,若c(Ni2+)=0.0100mol·dm-3时,原电池的电动势为0.315V,其中镍为负极,计算镍电极的标准电极电势。
第9题
A.铜电极的电极电势增大
B.锌电极的电极电势增大
C.原电池的电动势增大
D.原电池的电动势减小
第10题
已知某原电池的正极是氢电极,p(H2)为100kPa,负极的电极电势是恒定的。当氢电极中pH=4.008时,该电池的电动势是0.412V。如果氢电极中所用的溶液改为一未知c(H+)的缓冲溶液,又重新测得原电池的电动势为0.427V。计算该缓冲溶液的H+浓度和pH值。如该缓冲溶液中c(HA)=c(A-)=1.0mol·dm-3,求该弱酸HA的电离常数。
第11题
已知某原电池的正极是氢电极P(H2)=100kPa,负极的电极电势是恒定的,当氢电极中pH=4.008时,该电池的电动势为0.412V;如果氢电极中所用的溶液为—未知c(H+)的缓冲溶液,又重新测得原电池的电动势为0.427V。计算缓冲溶液的H+浓度和pH。若缓冲溶液中f(HA)=c(A—)=1.0mol.L—1,求该弱酸HA的解离常数。


为了保护您的账号安全,请在“赏学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 赏学吧
赏学吧



 微信搜一搜
微信搜一搜
 赏学吧
赏学吧