在723K时,将0.10mol H2(g)和0.20mol CO2(g)通入抽空的瓶中,发生如下反应: (1) H2(g)+CO2(g)H2O(g)+CO(g)
在723K时,将0.10mol H2(g)和0.20mol CO2(g)通入抽空的瓶中,发生如下反应:
(1) H2(g)+CO2(g)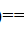 H2O(g)+CO(g)
H2O(g)+CO(g)
平衡后瓶中的总压为50.66kPa,经分析知其中水蒸气的摩尔分数为0.10。今在容器中加入过量的氧化钴CoO(s)和金属Co(s),在容器中又增加了如下两个平衡:
(2) CoO(s)+H2(g)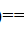 Co(s)+H2O(g)
Co(s)+H2O(g)
(3) CoO(s)+CO(g)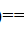 Co(s)+CO2(g)
Co(s)+CO2(g)
经分析知容器中的水蒸气的摩尔分数为0.30。试分别计算这三个反应用摩尔分数表示的平衡常数。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案


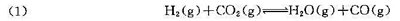
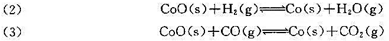

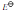 (Ag+/Ag)=0.7996V。
(Ag+/Ag)=0.7996V。