在25℃,1atm时,用铂电极电解1mol.dm-3的H2SO4溶液。(已知25℃时:电解液电阻为100Ω;+22θ(O/H,HO)1.229V(1)计算理论分解电压;(2)若两电极面积均为1cm2。氢气、氧气的超电势η与电流密度J的关系为-22-22H(g)/V=0.472+0.118lg(J/Acm),O(g)/V=1.062+0.118lg(J/Acm),当通过电流为1mA时,外加电压为多少。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“在25℃,1atm时,用铂电极电解1mol.dm-3的H2S…”相关的问题
更多“在25℃,1atm时,用铂电极电解1mol.dm-3的H2S…”相关的问题
第1题
25℃时用铂电极电解1mol·dm-3的H2SO4。(1)计算理论分解电压;(2)若两电极面积为1cm2,电解液电阻为100Ω,H2(g)和O2(g)的超电势η与电流密度J的关系分别为η(H2,g)/V=0.472+0.1181g[J/(A·cm-2)],η(O2,g)/V=1.062+0.118lg[J/(A·cm-2)],问当通过的电流为1mA时,外加电压为若干?
第2题
25°C下用铂电极电解1mol.dm-3的H2SO4水溶液.
(1)计算理论分解电压;
(2)若两电极面积均为1cm2,电解液电阻为100Ω,H2(g)和O2(B)的超电势η与电流密度J的关系分别为

问当通过的电流为1mA时,外加电压为若干?
第3题
298K时,用Pb(s)为电极来电解H2SO4溶液,已知其浓度为0.10mol·kg-1,γ±=0.265,若在电解过程中,把Pb阴极与另一甘汞电极相连组成原电池,测得其电动势E=1.0685V。试求H2(g)在Pb阴极上的超电势(只考虑H2SO4的一级解离)。已知所用甘汞电极的电极电势φ甘汞=0.2806V。
第4题
298 K时,用Pb(s )为电极来电解H2SO4溶液,已知其浓度为0.10 mol·kg-1,γ±=0. 265 ,若在电解过程中,把Pb阴极与另-甘汞电极相连组成原电池,测得其电动势E=1.0685V。试求H2(g)在Pb阴极上的超电势(只考虑H2SO4的一级解离)。已知所用甘汞电极的电极电势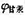 =0.2806V.
=0.2806V.
第5题
25℃时以铂为电极电解含有NiCl2(0.01mol·dm-3)和CuCl2(0.02mol·dm-3)的水溶液。若电解过程中超电势可忽略,问:
第7题
在298K和标准压力下,用镀铂黑的铂电极电解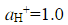 的水溶液,当所用的电流密度j=5×10-3A·cm-2时,计算使电解能顺利进行的最小分解电压。已知
的水溶液,当所用的电流密度j=5×10-3A·cm-2时,计算使电解能顺利进行的最小分解电压。已知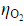 =0.487V,
=0.487V,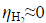 ,忽略电阻引起的电位降,H2O(l)的标准摩尔生成Gibbs自由能
,忽略电阻引起的电位降,H2O(l)的标准摩尔生成Gibbs自由能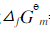 =-237.129kJ·mol-1。
=-237.129kJ·mol-1。
第8题
,测得E=1.050V,取此NaOH溶液20.00cm3,需上述HCl溶液多少立方厘米时才能完全中和? (已知25℃时,标准甘汞电极的电极电势为0.2828V,p(H2)=105Pa)
第9题
在298K和标准压力下,用镀铂黑的铂电极电解aH+=1.0的水溶液,当所用的电流密度j=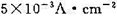 时,计算使电解能顺利进行的最小分解电压。已知
时,计算使电解能顺利进行的最小分解电压。已知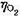 =0.487V,
=0.487V,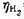 ≈0,忽略电阻引起的电位降,H2O(I)的标准摩尔生成Gibbs自由能
≈0,忽略电阻引起的电位降,H2O(I)的标准摩尔生成Gibbs自由能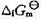 =-237.129kJ·mol-1.
=-237.129kJ·mol-1.
第10题
电解1.000×10-2mol·L-1硫酸锌溶液,当介质为0.50mol·L-1硫酸溶液时,锌是否能在铂电极上析出?如果介质[H<sup>+</sup>]=10-5mol·L-1时,锌是否能析出?(在锌电极上,ηH2=-0.70V;E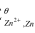 (zn2+/zn)=-0.763V)
(zn2+/zn)=-0.763V)
第11题
994V。
(1)写出电极反应和电池反应:
(2)25℃时实验测得H2SO4浓度为b时,上述电池的电动势为0.623V。已知此H2SO4溶液的离子平均活度因子y±=0.7,求b为多少;
(3)计算Ag2SO4(s)的活度积Ksp^θ。


为了保护您的账号安全,请在“赏学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 赏学吧
赏学吧



 微信搜一搜
微信搜一搜
 赏学吧
赏学吧