题目内容
(请给出正确答案)
[主观题]
试根据范德瓦斯斯方程,计算温度为0℃,摩尔体积为0.55L/mol的二氧化碳的压强,并将结果与用理想气体物体方程计
算的结果相比较。
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“试根据范德瓦斯斯方程,计算温度为0℃,摩尔体积为0.55L/…”相关的问题
更多“试根据范德瓦斯斯方程,计算温度为0℃,摩尔体积为0.55L/…”相关的问题
第3题
第5题
对于CO2气体有范德瓦耳斯常量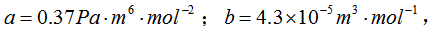 0°C时其摩尔体积为6.0x10-4m3·mol-1。试求其压强。如果将其当作理想气体处理,结果又如何?
0°C时其摩尔体积为6.0x10-4m3·mol-1。试求其压强。如果将其当作理想气体处理,结果又如何?
第7题
第8题
某自激振动系统以数学形式表示如下(范德波尔方程):
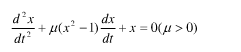 (μ>0)
(μ>0)
试讨论系统的平衡状态(即驻定解)的稳定性态.
第9题
已知范徳瓦耳斯气体物恋方程为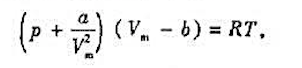
其内能为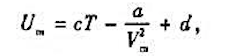
其中a,b,c,d均为常量。试求:(1)该气体从V1等温膨胀到V2时系统对外界所做的功;(2)该气体在定体下升高△T温度所吸收的热量。
第10题
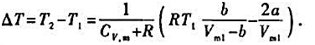
试在T1-Vm1图上画出△T=0的曲线(即转换温度曲线),并加以讨论.


为了保护您的账号安全,请在“赏学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 赏学吧
赏学吧



 微信搜一搜
微信搜一搜
 赏学吧
赏学吧