用电解方法分离浓度均为8.00×10-2mol?L -1 Zn2+和Ni2+的混合溶液。试问 (1)哪一离子先析出?阴极
用电解方法分离浓度均为8.00×10-2mol?L -1 Zn2+和Ni2+的混合溶液。试问 (1)哪一离子先析出?阴极电位应维持在什么范围内,才可能使这两金属离子分离[vs.SHE(与标准氢电极相比)]? (2)要达到定量分离,阴极电位应维持在什么范围(vs.SHE)?(已知
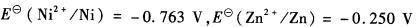 )
)
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
用电解方法分离浓度均为8.00×10-2mol?L -1 Zn2+和Ni2+的混合溶液。试问 (1)哪一离子先析出?阴极电位应维持在什么范围内,才可能使这两金属离子分离[vs.SHE(与标准氢电极相比)]? (2)要达到定量分离,阴极电位应维持在什么范围(vs.SHE)?(已知
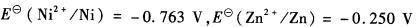 )
)
 如搜索结果不匹配,请 联系老师 获取答案
如搜索结果不匹配,请 联系老师 获取答案
 更多“用电解方法分离浓度均为8.00×10-2mol?L -1 Z…”相关的问题
更多“用电解方法分离浓度均为8.00×10-2mol?L -1 Z…”相关的问题
第1题
在298K和标准压力下,用电解沉积法分离Cd2+、Zn2+混合溶液。已知Cd2+和Zn2+的浓度均为0.10mol·kg-1(设活度因子均为1),H2(g)在Cd(s)和Zn(s)上的超电势分别为0.48V和0.70V,设电解液的pH值保持为7.0。试问:

第2题
在298K和标准压力下,用电解沉积法分离Cd2+、Zn2+混合溶液。已知Cd2+和Zn2+的浓度均为0.10 mol·kg-1(设活度因子均为1),H2(g)在Cd(s)和Zn(s)上的超电势分别为0.48 V和0.70V,设电解液的pH值保持为7.0。试问:(1)阴极上首先析出何种金属? (2)第二种金属析出时第一种析出的离子的残留浓度为多少?(3)氢气是否有可能析出而影响分离效果?
第3题
第4题
用电解沉积的办法分离Cd2+和Zn2+,已知H2在Cd上的超电势为0.48V,在Zn上的超电势为0.70V,溶液中的Cd2+和Zn2+浓度皆为0.1mol/kg。(已知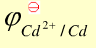 =-0.403V,
=-0.403V,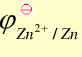 =-0.763V,离子的活度系数均为1,溶液的pH保持中性。)通过计算回答下面的问题:
=-0.763V,离子的活度系数均为1,溶液的pH保持中性。)通过计算回答下面的问题:
第5题
已知溶液中Cd2+和Zn2+浓度均为0.1mol.kg-1,H2在Pt、Cd和Zn上的超电势分别为0.12V、0.48V和0.70V。问25℃时能否用Pt作为电极以电解沉积Cd2+的方法来分离溶液中的Cd2+和Zn2+?已知25℃时,
1.jpg) 假设电解过程中保持溶液的pH=7,析出的H2(g)压力为100kPa。
假设电解过程中保持溶液的pH=7,析出的H2(g)压力为100kPa。
第6题
用电解沉积的办法分离Cd2+和Zn2+,已知H2在Cd上的超电势为0.48V,在Zn上的超电势为0.70V,溶液中的Cd2+和Zn2+浓度皆为0.1 moL/kg。(已知
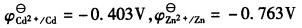 ,离子的活度系数均为1,溶液的pH保持中性。)通过计算回答下面的问题: (1)哪种金属首先在阴极上析出? (2)第二种金属开始析出时,前一种金属剩下的浓度为多少? (3)当H2开始析出时,溶液中残留的两种金属的浓度各为多少?
,离子的活度系数均为1,溶液的pH保持中性。)通过计算回答下面的问题: (1)哪种金属首先在阴极上析出? (2)第二种金属开始析出时,前一种金属剩下的浓度为多少? (3)当H2开始析出时,溶液中残留的两种金属的浓度各为多少?
第7题
第8题
某溶液中含有Ca2+、Ba2+,其浓度均为0.1mol·L-1,缓慢加入Na2SO4,开始生成的是何沉淀?开始沉淀时
第9题
A.首先析出 Ag,最后析出 H2
B.首先析出 Fe,最后析出 H2
C.首先析出 Ag,最后析出 Fe
D.首先析出 Cu,最后析出 Fe
第10题
用电解NaCl水溶液的方法制备NaOH,在通电一段时间后,得到了浓度为1.0mol·dm-3的NaOH溶液0.6dm3,在与之串联的铜库仑计中析出了30.4gCu(s)。计算该电解池的电流效率。


为了保护您的账号安全,请在“赏学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!

 微信搜一搜
微信搜一搜
 赏学吧
赏学吧



 微信搜一搜
微信搜一搜
 赏学吧
赏学吧